Lateral-Flow-Test

Der Lateral-Flow-Test, auch Lateral-Flow-Assay (englisch für „seitlicher Flusstest“) ist eine biochemische Methode zum qualitativen Nachweis von Stoffen (z. B. Antigenen) mit Antikörpern.[1][2][3] Der Lateral-Flow-Test ist eine Kombination aus einer Dünnschichtchromatographie und einer Immunfärbung. Aufgrund des im Vergleich zu anderen Immunassays geringeren Geräteaufwands werden Lateral-Flow-Tests oftmals in Form von Teststreifen verwendet,[4] z. B. Schwangerschaftsteststreifen, Drogenteststreifen, Influenza- und Corona-Schnelltests oder Allergenschnelltests.
Prinzip
[Bearbeiten | Quelltext bearbeiten]Die zu untersuchende Probe wird auf den Probenbereich (englisch sample pad) auf einem Teststreifen aus porösem Papier, Glasfaser oder gesintertem Polymer aufgetragen (1). Die Probe beginnt nach Zugabe des Laufmittels mit der Ausbreitung über den Teststreifen aufgrund von Kapillarkräften (Dünnschichtchromatographie). Die Probe wandert mit der Flüssigkeit zu einem Bereich, wo sich getrocknete Immunkonjugate mit Salzen und Kohlenhydraten befinden (englisch conjugate pad) (2). Die Flüssigkeit löst das Immunkonjugat, wodurch es an die nachzuweisenden Moleküle (das Antigen) in der Probe binden kann, sofern vorhanden. Die Flüssigkeit wandert weiter in den Kapillarbereich aus Nitrozellulose (englisch capture pad) (3), wo in einem kleinen Abschnitt ein Antikörper immobilisiert wurde. Dieser bindet an einer anderen Stelle (Epitop) auf der Oberfläche des nachzuweisenden Moleküls (4) und fixiert das Immunkonjugat dadurch auf der Testlinie (T, englisch test line), während die Flüssigkeit weiterwandert. Durch die Anreicherung des nachzuweisenden Moleküls entsteht anhand des gebundenen Immunkonjugats je nach Art des Sensors z. B. eine Färbung, eine Fluoreszenzfärbung oder eine magnetische Markierung. Auf dem Teststreifen befindet sich noch ein Bereich mit immobilisierten sekundären Antikörpern für eine Positivkontrolle (C, englisch control line). Diese binden an den Antikörpern überschüssiger Immunkonjugate und zeigen damit die Funktionsfähigkeit des Tests an (5). Gelegentlich wird nebenbei ein zweiter Teststreifen verwendet, der als Negativkontrolle mit Kontrollflüssigkeit verwendet wird und falsch-positive Ergebnisse ausschließt.[5]

Lateral-Flow-Tests können sowohl qualitativ als auch quantitativ ausgewertet werden. Ein qualitativer Test untersucht nur die Probe auf die An- oder Abwesenheit eines gesuchten Analyten, während ein quantitativer Lateral-Flow-Test auch die Konzentration des gesuchten Analyten angeben kann. Dies geschieht über die Interpretation der Bandenintensität des Analyten mit Hilfe eines optischen Lesegerätes. Das Lesegerät vergleicht hierbei die Bandenintensität mit einer hinterlegten Standardkurve und kann darüber eine Konzentration für den Analyten ausgeben. Quantitative Tests können sowohl über sichtbare Färbung der Testbanden (z.b. Goldkonjugat) als auch über Fluoreszenzmarkierte Färbung der Testbanden ausgewertet werden.
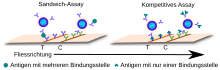
Je nach Art des Immunkomplexes auf der Testlinie unterscheidet man zwei Varianten mit gegensätzlichem Linienmuster bei positivem und negativem Ergebnis. Zum Nachweis von großen Antigenen mit mehreren Bindungsstellen für Antikörper (z. B. Viren, Bakterien) eignen sich Sandwich-Assays. Dabei wird an der Testlinie ein Sandwich-Komplex aus Immunkonjugat-Antigen-Antikörper gebildet. Ein positiver Test zeigt dann zwei Linien. Kleine Antigene mit nur einer Bindungsstelle für Antikörper (z. B. Stoffwechselprodukte, Drogen) sind durch kompetitive Assays nachweisbar. Bei diesen binden die Immunkonjugate an immobilisierten Antigenen auf der Testlinie, solange sie nicht durch Antigene aus der Probe abgesättigt sind. Ein positiver Test zeigt daher nur eine Linie.[6]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Welche Covid-19 Schnelltests gibt es und wie funktionieren sie? auf science.lu
- Funktionsweise eines Lateral-Flow-Tests auf der Webseite der Fassisi GmbH
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ L. Kulinsky, Z. Noroozi, M. Madou: Present technology and future trends in point-of-care microfluidic diagnostics. In: Methods in Molecular Biology (Clifton, N.J.). Band 949, 2013, S. 3–23, ISSN 1940-6029. doi:10.1007/978-1-62703-134-9_1. PMID 23329432.
- ↑ C. Rozand: Paper-based analytical devices for point-of-care infectious disease testing. In: European Journal of Clinical Microbiology & Infectious Diseases. Band 33, Nummer 2, Februar 2014, S. 147–156, ISSN 1435-4373. doi:10.1007/s10096-013-1945-2. PMID 23982665.
- ↑ A. St John, C. P. Price: Existing and Emerging Technologies for Point-of-Care Testing. In: Clinical Biochemist Reviews. Band 35, Nummer 3, August 2014, S. 155–167, ISSN 0159-8090. PMID 25336761. PMC 4204237 (freier Volltext).
- ↑ A. K. Yetisen, M. S. Akram, C. R. Lowe: Paper-based microfluidic point-of-care diagnostic devices. In: Lab on a Chip. Band 13, Nummer 12, Juni 2013, S. 2210–2251, ISSN 1473-0189. doi:10.1039/c3lc50169h. PMID 23652632.
- ↑ Brendan O’Farrell: Evolution in Lateral Flow–Based Immunoassay Systems. In: Lateral Flow Immunoassay. Humana Press, Totowa, NJ 2009, ISBN 978-1-59745-240-3, S. 1–33, doi:10.1007/978-1-59745-240-3_1, PMC 7119943 (freier Volltext) – (springer.com [abgerufen am 15. Februar 2023]).
- ↑ Kathryn H. Ching: Lateral Flow Immunoassay. In: ELISA. Band 1318. Springer New York, New York, NY 2015, ISBN 978-1-4939-2741-8, S. 127–137, doi:10.1007/978-1-4939-2742-5_13 (springer.com [abgerufen am 15. Februar 2023]).